Leupeptin
- Abpackungen
- Analysenzertifikate (Lot-Nr. - Erscheinungsdatum)
- Manuals & Technical Notes
- Zusätzliche Informationen
- Verwandte Produkte
- Produktlinks
C20H38N6O4·1/2H2SO4 • Mr 475.6 • CAS [103476-89-7]
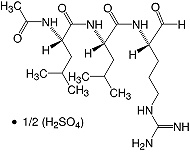
Leupeptin, oder N-Acetyl-L-leucyl-L-leucyl-L-argininal, ist ein natürlich vorkommendes Tripeptid und ein reversibler Inhibitor von Serin- und Cysteinproteasen. Es hemmt kompetitiv Calpain, Cathepsin B, Kallikrein, Papain, Plasmin und Trypsin, ist aber wenig oder nicht hemmend für Pepsin, Cathepsin A und D, Chymotrypsin und Thrombin.
Leupeptin bildet im aktiven Zentrum von Serinproteasen ein kovalentes Hemiacetal-Addukt zwischen der Aldehydgruppe von Leupeptin und der Hydroxylgruppe eines Serinrestes im aktiven Zentrum des Enzyms. Die Hemmung von Cysteinproteasen wird durch die Bildung einer vergleichbaren Bindung zwischen dem elektrophilen (Aldehyd-)Kohlenstoff von Leupeptin mit dem Schwefelatom eines Cysteinrestes im aktiven Zentrum des Enzyms erreicht.
Aufgrund seiner Aldehydgruppen kann Leupeptin mit Proteinnachweis-Assays (z. B. Bradford) interferieren.
Stammlösung: 5 mg/ml (10 mM) in H2O, Ethanol, Essigsäure und DMF (stabil bei +4 °C für ca. 7 Tage und bei -20 °C für ca. 6 Monate)
Arbeitskonzentration: 1 - 100 µM (stabil nur für wenige Stunden)
|
Gehalt (HPLC) (Summe tautomerer Isomere) |
min. 96,5 %
|
References:
- Umezawa, H. (1976) Methods Enzymol. 45, 678-83
- Carlin, C. et al. (1994) J. Cell. Physiol. 160, 427-34
- Savory, P.J. & Rivett, A.J. (1993) Biochem. J. 289, 45-8
- Eto, I. & Bandy, M.D. (1990) Mol. Cell. Biochem. 94, 19-36
- Benistani, B. et al. (1994) Biochim. Biophys. Acta 1223, 84-90
 |
| WARNUNG |
| Gefahrenhinweise | H302 - H332 |
| Vorsichtsmaßnahmen | P280 |
| Reaktion | P301 +P312 - P304 +P340 - P330 |
| Lagerung | P501 |
WGK: 1 • HS: 29241900
Lagertemperatur: -15 °C to -25 °C








